El nuevo fármaco para el alzhéimer se asocia con dos muertes
Lecanemab, que ha demostrado reducir el deterioro cognitivo, podría estar relacionado con dos muertes en personas tratadas con este innovador medicamento, aunque está por demostrar
Buenas y malas noticias para las personas y las familias que sufren enfermedad de Alzheimer. Por un lado, la revista NEJM publicó ayer los resultados del ensayo clínico de fase III con el fármaco lecanemab, desarrollado por Eisai y Biogen, en que se muestra que el medicamento reduce la tasa de deterioro cognitivo en un 27 % en pacientes en las primeras etapas de la enfermedad, lo que lo convierte en el primer fármaco de su tipo en producir resultados de ensayo tan positivos.
La otra buena noticia fue la aprobación acelerada, con polémica, en julio de 2022 de aducanumab, un anticuerpo monoclonal de Biogen, que a dosis altas es capaz de eliminar las placas de la proteína amiloide del cerebro que se han acumulado durante años. Esas placas son características de las personas con alzhéimer, ya que impiden la conexión correcta entre las neuronas y provocan su degeneración.
Se trataba del primer medicamento en casi dos décadas contra esta enfermedad al que se le da luz verde. El aducanumab es un anticuerpo monoclonal que combate las acumulaciones de la proteína amiloide en el cerebro de los pacientes de alzhéimer, y que está detrás de una de las teorías de cómo funciona la enfermedad.
La autorización de este fármaco estuvo cargada de polémica porque muchos expertos han dudado de su eficacia. El comité independiente de asesores de las autoridades sanitarias de EE.UU. (FDA) rechazó el pasado noviembre dar su apoyo al medicamento por dudas sobre su impacto beneficioso y sobre posibles riesgos registrados durante los ensayos clínicos.
Entre los riesgos más relevantes estaba el de hemorragias cerebrales.
Y precisamente esta semana se confirmó la segunda muerte potencialmente relacionada con lecanemab. Se trata del caso de una mujer de 65 años que murió de una hemorragia masiva después de sufrir un derrame cerebral y un tipo de inflamación y sangrado cerebral en un ensayo de Eisai, según un informe de la revista Science.
Essai asegura que las muertes no podían atribuirse directamente al lecanemab
La compañía japonesa, aunque no descarta la posibilidad de que su medicamento contra el alzhéimer haya contribuido a las hemorragias cerebrales en dos pacientes que murieron durante los ensayos clínicos, pero a través de un comunicado insistió en que su medicamento no fue responsable de sus muertes.
La compañía asegura que las muertes no podían atribuirse directamente al lecanemab.
Los dos pacientes que murieron, una mujer de 65 años y un hombre de 80 años, también habían tomado medicamentos anticoagulantes. Eso llevó a Eisai a recomendar a los médicos que alertaran sobre riesgos y beneficios con los cuidadores y los pacientes antes de recetar el tratamiento a quienes toman medicamentos anticoagulantes.
Eisai defiende la seguridad de su terapia con anticuerpos monoclonales, el primer fármaco para retrasar la progresión del alzhéimer en un gran ensayo de estudio, que ha generado esperanzas de un nuevo tratamiento para una enfermedad que afecta a 50 millones de personas en todo el mundo.
«Lecanemab redujo los marcadores de amiloide en la enfermedad de Alzheimer temprana y resultó en una disminución menor que el placebo en todas las medidas de cognición y función a los 18 meses», destaca Christopher Van Dyck, director del Centro de Investigación de la Enfermedad de Alzheimer de Yale y autor del informe en NEJM.
Los investigadores siguieron a casi 1.800 pacientes en el transcurso de 18 meses y encontraron que el fármaco «logró en una disminución moderadamente menor en las medidas de cognición y función», en comparación con los pacientes que recibieron un placebo.
Sin embargo, las compañías señalaron que «se justifican ensayos más prolongados para determinar la eficacia y seguridad de lecanemab en la enfermedad de Alzheimer temprana».
Si bien es cierto que el estudio demuestra un menor declive cognitivo en los pacientes tratados con lecanemab, «habrá que determinar cuál es la relevancia clínica», advierte a Science Media Center Marc Suárez-Calvet, del IMIM-Hospital del Mar y del Barcelona Beta Brain Research Center en la Fundación Pasqual Maragall.
«Una diferencia de 0.45 en la escala del CDR-SB, que tiene un rango de 0 a 18, puede parecer menor. Sin embargo, pequeños cambios en la cognición pueden tener un gran impacto no solo en la autonomía de los pacientes, sino también en sus cuidadores y cuidadoras», reconoce.
Los pacientes que tienen la enfermedad de Alzheimer tienen una acumulación de dos proteínas, amiloide-beta y tau, en el cerebro. Se agrupan y forman placas, lo que interrumpe la función celular y causa síntomas como pérdida de memoria y confusión.
Los pacientes que tienen la enfermedad de Alzheimer tienen una acumulación de dos proteínas, amiloide-beta y tau, en el cerebro
Los resultados del ensayo prueban la teoría de que la eliminación de los depósitos de una proteína llamada beta amiloide del cerebro de las personas con alzhéimer temprano puede retrasar el avance de la enfermedad. Esas placas son características de las personas con alzhéimer, ya que impiden la conexión correcta entre las neuronas y provocan su degeneración.
Eisai busca la aprobación del medicamento de las autoridades sanitarias de EE.UU. (FDA) de manera acelerada, y se espera una decisión a principios de enero. La compañía dijo que también buscará autorización en Japón y Europa antes del 31 de marzo de 2023.
Si finalmente se aprueba el medicamento sería el segundo en 20 años, después de la aprobación el pasado de año de aducanumab, un anticuerpo monoclonal que a dosis altas es capaz de eliminar las placas de la proteína amiloide del cerebro que se han acumulado durante años.
El tratamiento con lecanemab podría superar los 40.000 euros. Biogen ha fijado el precio de aducanumab en 56.000 dólares anuales por paciente (unos 46.000 euros).
Esta funcionalidad es sólo para suscriptores
Suscribete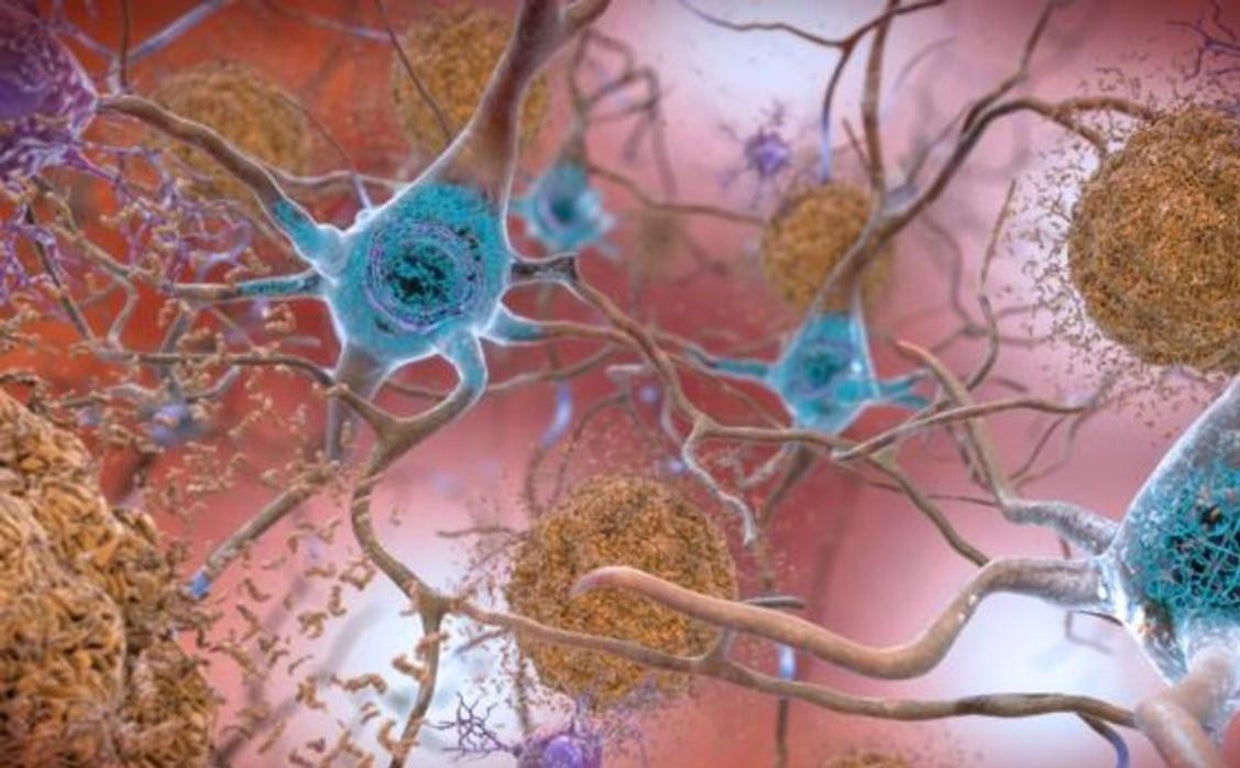
Esta funcionalidad es sólo para suscriptores
Suscribete